植物细胞全能性和再生
1 植物细胞全能性的基本概念
高等植物的器官源于茎端分生组织(shoot apical meristem, SAM)、根端分生组织(root apical meristem, RAM)和侧生分生组织(lateral meristem)。存在于分生组织的干细胞既可以通过细胞分裂维持自身细胞群的大小,同时又可以进一步成为各种不同组织或者器官的细胞,从而构成机体各种复杂的组织器官。
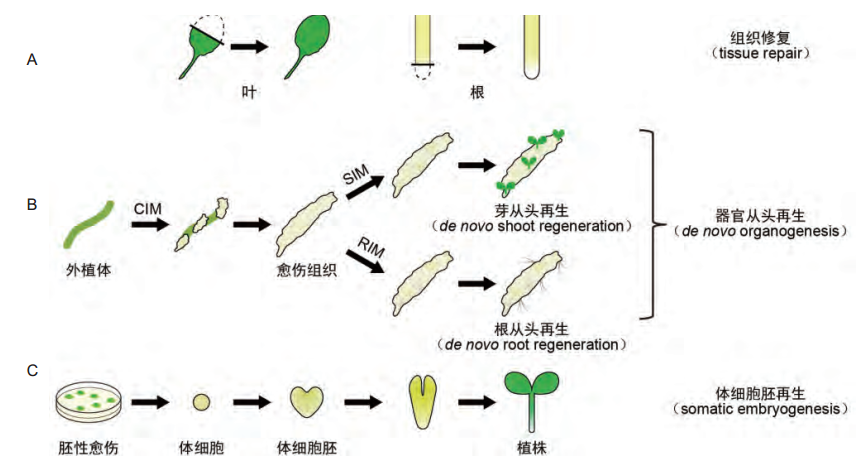
高等植物的再生可分为以下三种:组织修复(tissue repair);器官从头再生,包括根从头再生(de novo root regeneration)和芽从头再生(de novo shoot regeneration);体细胞胚再生(somatic embryogenesis)(图1)。组织修复是指组织或器官在损伤或缺失后,可以修复或重新生长出能够替代原来组织器官行使功能的结构。根和芽的从头再生是指受伤或离体的植物组织长出不定根或不定芽的过程。器官从头再生是植物再生的重要方式,与体细胞胚再生不同,植物器官从头再生的过程仅需诱导外植体(explant,即离体组织或器官)形成SAM和RAM,无需经过类似胚胎发育的过程。体细胞胚再生是指已分化的体细胞在一定条件下脱分化或得分生能力,经过类似胚胎发育的过程形成完整植株。
2 植物再生现象的机制和应用
2.1 植物愈伤组织形成和芽从头再生的分子调控
愈伤组织(callus)指植物体受到外界损伤、病虫害侵染等时在损伤部位形成的不规则的细胞团, 而在植物的离体再生体系中, 离体组织或器官可通过植物激素的诱导定向形成具有再生能力的细胞团也被称为愈伤组织. 愈伤组织诱导一直被认为是细胞脱分化获得全能性的过程。
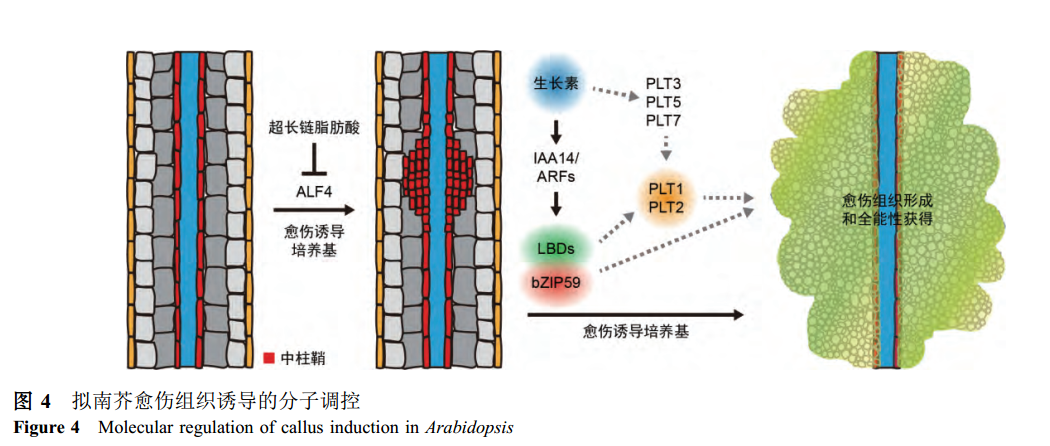
近年来利用模式植物拟南芥的离体再生体系揭示了植物离体器官愈伤组织的细胞起源和分子特征。拟南芥的根和下胚轴在诱导愈伤组织的培养基上,其木质部极的中柱鞘细胞首先发生几轮垂周分裂产生小细胞,接着再发生平周分裂,之后不断地进行细胞分裂形成愈伤组织。与此类似的是,拟南芥地上器官包括叶片和花瓣外植体的愈伤组织也是起始于维管周围特异表达中柱鞘标志基因的细胞,称为类中柱鞘细胞。如果用特异白喉毒素A链(diphtheria toxin chain A, DTA)去除木质部极中柱鞘细胞,则外植体不能产生愈伤组织。因此,离体培养中不同外植体愈伤组织似乎主要起始于组织内的中柱鞘或类中柱鞘细胞。进一步以拟南芥根原基各细胞层标记分析来自根、子叶和花瓣为外植体愈伤组织的细胞属性发现,根原基分生组织的标志基因WOX5, SCARECROW(SCR), SHORT ROOT(SHR)和PLETHORA 1(PLT1)在愈伤组织中高度表达,说明愈伤组织细胞属性类似根端分生组织的特征。三种外植体愈伤组织诱导前后的转录组分析也表明,愈伤组织诱导后,根分生组织相关基因的表达发生明显上调;与茎端分生组织或者胚胎相比,愈伤组织的分子特性更类似于根分生组织。此外,侧根起始缺陷突变体alf4的根、子叶和花瓣外植体在CIM上不能形成愈伤组织,进一步佐证了生长素诱导的愈伤组织是中柱鞘类细胞以类似侧根发生的方式,具有根分生组织特征。
目前的研究显示, 外植体在诱导愈伤组织培养基上形成愈伤组织过程中, 除了能够促进中柱鞘类细胞增殖外, 其细胞命运转变为根分生组织的特性对于获得芽再生能力非常重要。在此过程中,生长素可以诱导PLT3,PLT5和PLT7的表达,而三个转录因子又可激活根分生组织的特征基因PLT1和PLT2以及芽再生特征因子CUP-SHAPED COTYLEDON 1(CUC1)和CUC2的表达从而赋予愈伤组织再生芽的能力。plt3 plt5 plt7突变体在CIM培养基上愈伤组织形成正常, 但是它们的愈伤组织不能再生芽, 而过表达PLT1和CUC1能够恢复plt3 plt5 plt7突变体愈伤组织的芽再生能力。综上, 这些发现表明, 获得根分生组织特性包括PLT1,WOX5以及SCR等的激活可能是赋予愈伤组织芽再生能力的必要因素(图4).
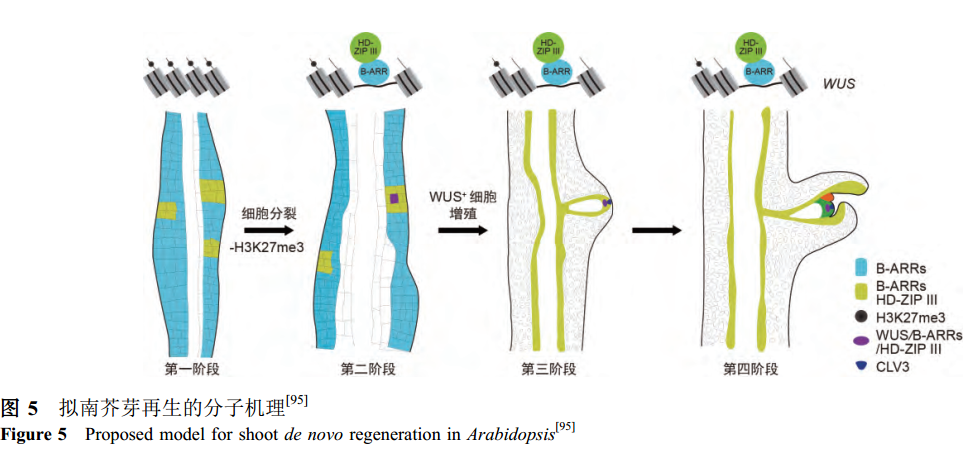
1957年, Skoog和Miller发现, 将愈伤组织转移到高细胞分裂素的生芽培养基(shoot-inducing medium,SIM)上是诱导芽再生的必需条件。通过遗传学、活体细胞成像和分子生物学等手段, 拟南芥芽再生的分子框架图以及细胞分裂素诱导茎端分生组织重新建立的“two-step”模型被相继提出。WUSCHEL(WUS)是芽从头再生的重要调控因子。WUS是第一个被发现的WOX基因, 它在SAM干细胞龛的组织中心(organizer center, OC)表达,对于维持SAM干细胞活性至关重要。
研究发现, wus突变体完全丧失芽再生能力,表明WUS也是调控芽再生的关键因子。根据WUS的表达特征, 将芽再生过程划分为四个时期:在芽再生起始阶段, WUS非常特异地表达在单个细胞中, 之后经历细胞增殖的过程, 随后分化出茎端分生组织干细胞。WUS的表达直接受到细胞分裂素信号途径关键因子-B型ARABIDOPSIS RESPONSE REGULATOR (ARR)转录因子的调控。B型ARR直接结合到WUS启动子区域, 并激活WUS的表达。B型ARR对WUS的激活分为两步, 具有严格的时空性. 首先, 高细胞分裂素环境会导致WUS座位出现重编程. 随着愈伤组织的细胞分裂, WUS座位的H3K27me3表观抑制修饰逐渐丢失, 在2~3天后, WUS座位的染色质处于打开状态,可以被B型ARR激活。WUS重新激活的空间特异性与microRNA165/6(miR165/6)靶标的HOMEODOMAINLEUCINE ZIPPER III(HD-ZIP III)的转录因子密切相关. 与B型ARR的遍在表达不同, HD-ZIP III仅在愈伤组织的一部分细胞中表达. HD-ZIP III能够特异性地与B型ARRs结合, 形成转录复合体激活WUS, 从而决定了WUS表达的空间特异性(图5)
进一步研究表明, 在拟南芥和烟草中,年龄途径关键调控因子miR156的含量与植物再生能力呈正相关:过量表达miR156可以显著提高叶片的茎尖再生率. 从分子机制上看, 随着植物年龄的增长, miR156的表达逐渐降低,导致其靶基因SQUAMOSA PROMOTER BINDING PROTEIN-LIKE(SPL)类转录因子含量的上升. SPL可以与细胞分裂素信号途径的关键转录因子B-ARR结合, 导致B-ARR的转录激活活性受到抑制, 呈现细胞分裂素的不敏感性, 进而导致茎尖再生能力的下降. 这一研究成果表明, 年龄途径可以通过调控细胞分裂素的信号输出调控植物的再生能力, 提示年龄可能是植物细胞全能性的一个重要调控因素。
除了WUS座位的H3K27me3擦除外, LYSINE-SPECIFIC DEMETHYLASE 1-LIKE 3(LDL3)介导的组蛋白H3K4me2去乙酰化也是芽再生的一个先决条件. 缺失LDL3会导致芽再生能力的显著下降[98]. 研究发现,在CIM培养的后期, LDL3会擦除芽再生相关基因座位的H3K4me2表观标记. 有趣的是, H3K4me2表观标记的擦除虽然并不会立刻导致这些基因表达量的改变,但是会让这些基因处于一种准备(priming)状态. 当愈伤组织转移到SIM培养基上后, 这些基因便快速被诱导表达, 激活芽再生的发育程序。
2.2 体细胞胚胎发生
与通过愈伤组织-芽再生技术实现植物再生不同,多种植物外植体可以通过离体培养诱导胚胎发生, 包括雄配子体和雌配子体的单倍体细胞诱导和孢子体的营养体细胞诱导,即体细胞胚胎发生(somatic embryogenesis)。体细胞胚胎发生是指植物体细胞在未经生殖细胞融合的情况下, 模拟有性的合子胚胎发生而发育形成一个新个体的形态发生过程, 它是诱导植物细胞实现全能性的一种形式。
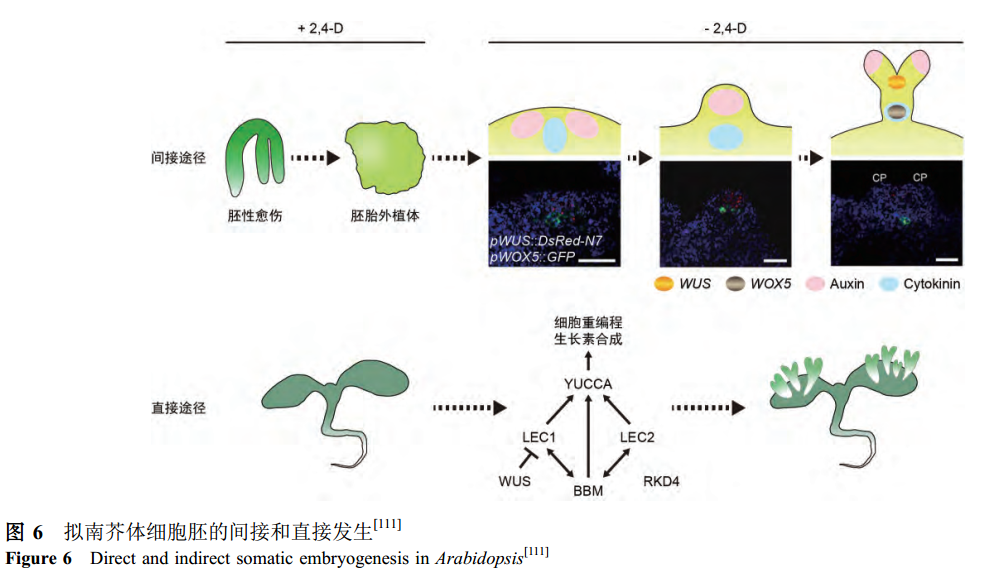
植物的体细胞经过重编程过程形成胚性愈伤组织, 再从愈伤组织的某些胚性细胞分化形成体细胞胚,这个过程称为体细胞胚的间接发生途径。研究表明, 间接的体细胞胚胎发生需要茎端分生组织的重新诱导形成[111]. 拟南芥茎端分生组织干细胞关键基因WUS最先在胚性愈伤组织的一小团细胞中特异激活表达, 此时并未观察到形态可见的体细胞胚, 而另一个干细胞特征基因CLV3随后在球形体细胞胚形成阶段被迅速诱导表达, 标志着愈伤组织中干细胞的出现和茎端分生组织的逐步形成. 影响拟南芥根端分生组织形成的关键调控因子WOX5和PLT2的表达模式与体细胞胚发生过程中胚根分生组织的建立有关。WOX5与WUS在体细胞胚发生过程中的早期就被诱导表达, 并且二者诱导表达时在胚性愈伤组织的表达区域基本重叠, 说明愈伤组织诱导体细胞胚的过程在该体系中可能是由多细胞起始的(图5)。
近年来, 关于体细胞胚胎发生的分子机理已经有了较深入的研究, 一些参与体细胞胚发生的重要的转录因子被鉴定出来, 它们可以归为以下4类. 第一类,拟南芥合子胚发育过程中的许多关键基因在诱导体细胞胚胎发生过程中起着十分重要的作用(图6)。LEAFY COTYLEDON(LEC)蛋白LEC1和LEC2是最初被发现的在幼苗中异位表达能诱导体细胞胚产生的转录因子。第二类可以诱导体细胞胚胎发生的转录因子是RWP-RK DOMAIN-CONTAINING 4(RKD4)/GROUNDED (GRD)。第三类转录因子称为BABY BOOM(BBM), 它是AP2/ERF转录因子中AINTEGUMENTA-LIKE(AIL)分支的成员之一,它的异位表达能够在没有外源激素的情况下使拟南芥幼苗的真叶和子叶上均能诱导体细胞胚的产生。第四类转录因子属于AP2/ERF转录因子家族. WIND1及其同源基因能够被损伤诱导表达, 并且在植物组织受损后能刺激愈伤组织细胞的增殖。