单细胞文章解析(4):Single-cell transcriptome analyses recapitulate the cellular and developmental responses to abiotic stresses in rice
植物的新陈代谢和繁殖依赖于细胞之间的分工。然而,具有多种功能的细胞通常被作为一个整体来研究,其特异性被稀释。在该研究中,作者将单细胞RNA测序应用于不同环境下生长的水稻幼苗,捕获了数千个细胞的转录组,识别出主要的细胞类型,并重建了它们的发育轨迹。作者发现,非生物胁迫不仅以细胞类型特异性的方式影响基因表达,而且还影响细胞的物理大小和细胞群的组成,并使用显微镜验证了这些结论。综上所述,该研究构建出水稻地上部分组织细胞转录组图谱,对植物学相关研究具有一定的指导意义。
测序数据介绍
品种:Oryza sativa ssp. japonica
部分:The aerial parts of these two-week-old seedlings were harvested for scRNA-seq.
处理:For the control sample, seedlings were grown in the Kimura B solution for 14 days. For the high-salinity treatment, seedlings were grown in the Kimura B solution for 11 days and transferred to the high-salinity solution (Kimura B solution plus 200mM NaCl) for another three days. For the low-nitrogen treatment, seedlings were grown in the Kimura B solution for nine days and were transferred to the low-nitrogen solution (Kimura B solution only containing 20 mM NH4+) for another five days.
测序方法:10x Genomics Single Cell 3′ Reagent Kits v2 protocol and were sequenced with Illumina HiSeq in the paired-end 150-nt mode.
主要结果
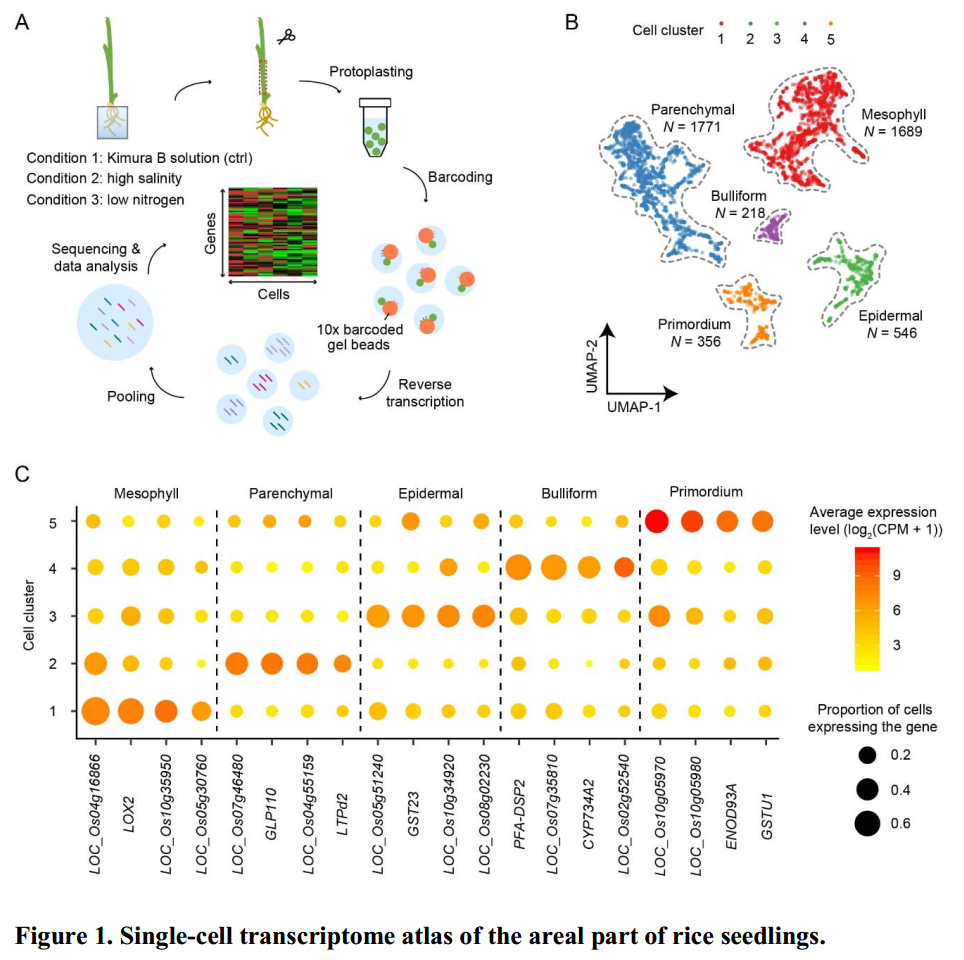
水稻幼苗地上部分组织的主要细胞类型
从对照、高盐处理和低氮处理的样本共获得4580个细胞的高质量数据,通过整合分群聚类,作者鉴定出五个主要的细胞类型,包括叶肉细胞(mesophyll)、薄壁细胞(parenchymal)、表皮细胞(epidermal)、泡状细胞(bulliform)、原基细胞(primordium)。
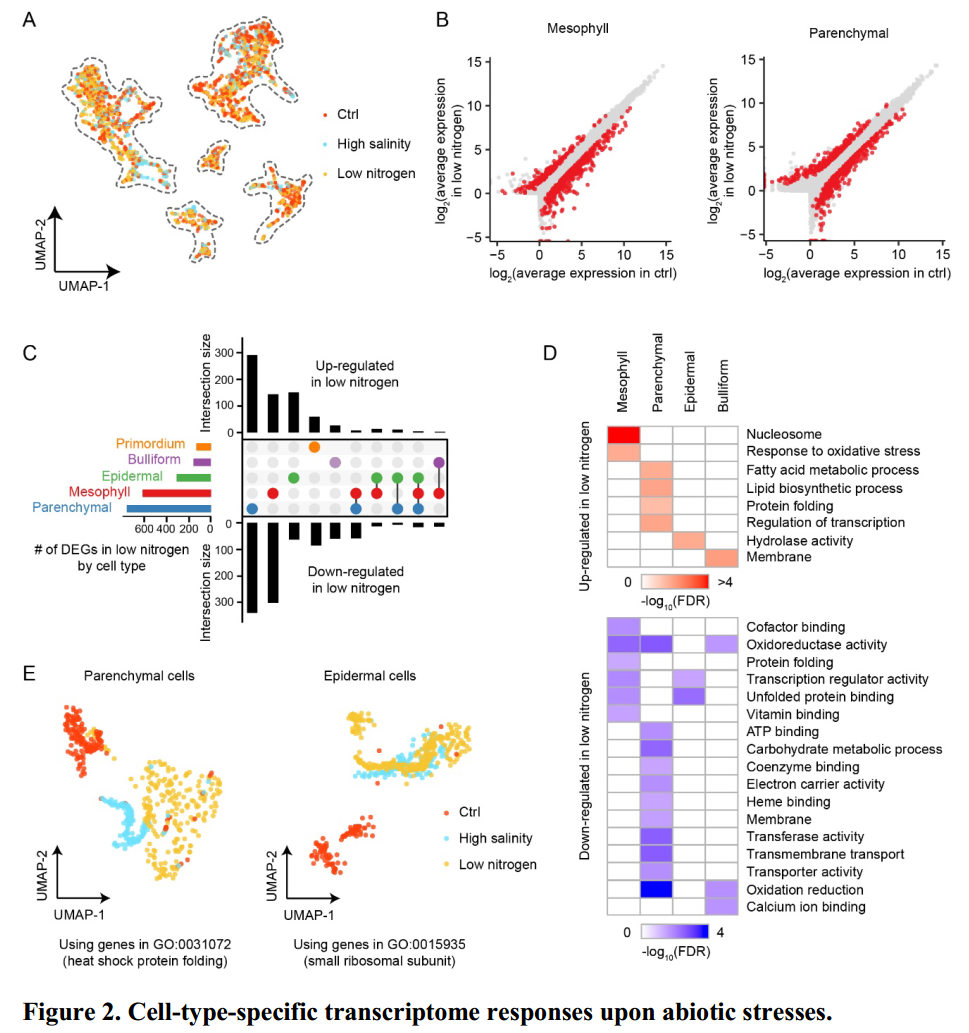
非生物胁迫诱导的单细胞转录水平变化因细胞类型而异
三种处理条件下,上述五类细胞都被检测到。通过对每个细胞类进行差异分析,作者发现低氮或高盐处理下,大部分基因的表达水平仅在单个细胞类群中发生改变。不同细胞类群中的差异基因富集于不同的GO terms中。例如在低氮条件下,叶肉细胞中的差异上调基因的主要功能是氧化应激反应,叶肉细胞中表达水平被抑制的基因功能主要是氧化还原酶活性。因此,叶肉细胞中氧化代谢和氨代谢之前存在着某种强烈的关系。
这部分分析内容的结果并不出乎意外,因为细胞之所以被分成不同的细胞类型是因为基因的表达水平的不同,所以不同类型的细胞在其面对非生物胁迫下做出响应的基因也会具有特异性。
高盐和低氮条件下同一细胞类型具有相似的转录调控机制
这部分对每个细胞类群在两种非生物胁迫条件下的差异基因之间的交集进行了统计。作者发现,在每个细胞类群中,两种处理条件下的差异基因具有显著的重叠。也就是说,不同非生物胁迫条件下同类型的细胞具有相似的转录调控机制。为了进一步说明该观点,作者使用某一GO中的基因对所有细胞重新进行聚类,结果显示非生物胁迫下的细胞聚集在一起远离正常处理条件下的细胞(Fig 2E)。
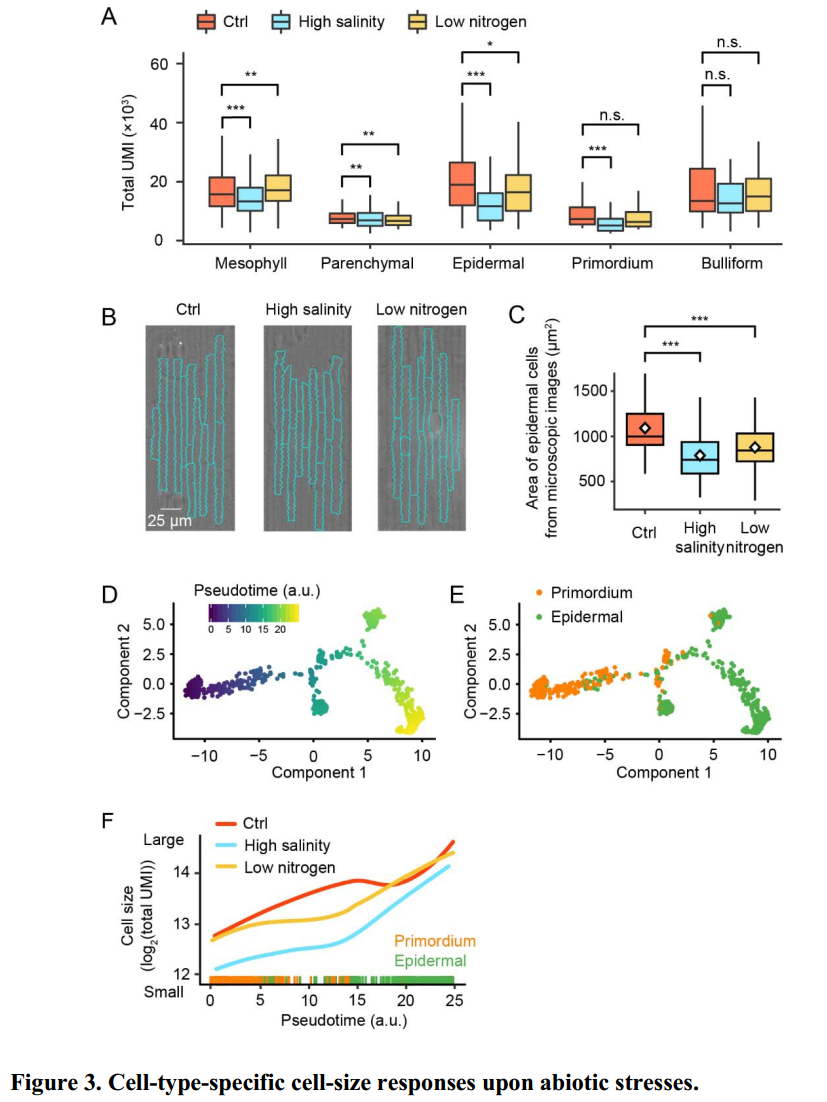
表皮细胞中随着单个细胞mRNA的降低其物理大小也随之变小
在scRNA-seq中,UMI与单个细胞中mRNA的含量等价。由图(Fig 3A)可知,在不同的非生物胁迫条件下,每种细胞类型的mRNA总量发生了显著的变化。特别是在表皮细胞中,与正常处理相比,不论在低氮或高盐处理下,其mRNA总量都发生了显著的降低。研究发现,在人类中单个细胞的mRNA数量和它的物理大小呈正相关(Chen et al., 2019; Kempe et al., 2015)。此外,总的mRNA量同样也反映了一个细胞中RNA聚合酶的活性。为了验证上述观点,作者对表皮细胞进行了显微镜观察,如图(Fig 3B-C)所示。通过对不同非生物胁迫条件下表皮细胞物理大小的统计发现其细胞确实变小。因此,整合上述所有信息,我们可以得出如下结论:表皮组织中单个细胞总的UMI数量与其细胞物理大小呈正比。
为了进一步解释在非生物胁迫条件下细胞变小的机制,作者构建了原基细胞分化为表皮细胞的轨迹(Fig 3D-E)。随着发育时间的增加,三种条件下细胞形状也逐渐变大,但是增长的速率却具有较大的差异,并且与正常条件相比,盐处理条件下细胞形状较小。
总的来说,以上结果表明细胞在形状大小特异性的变化与非生物胁迫紧密相关。
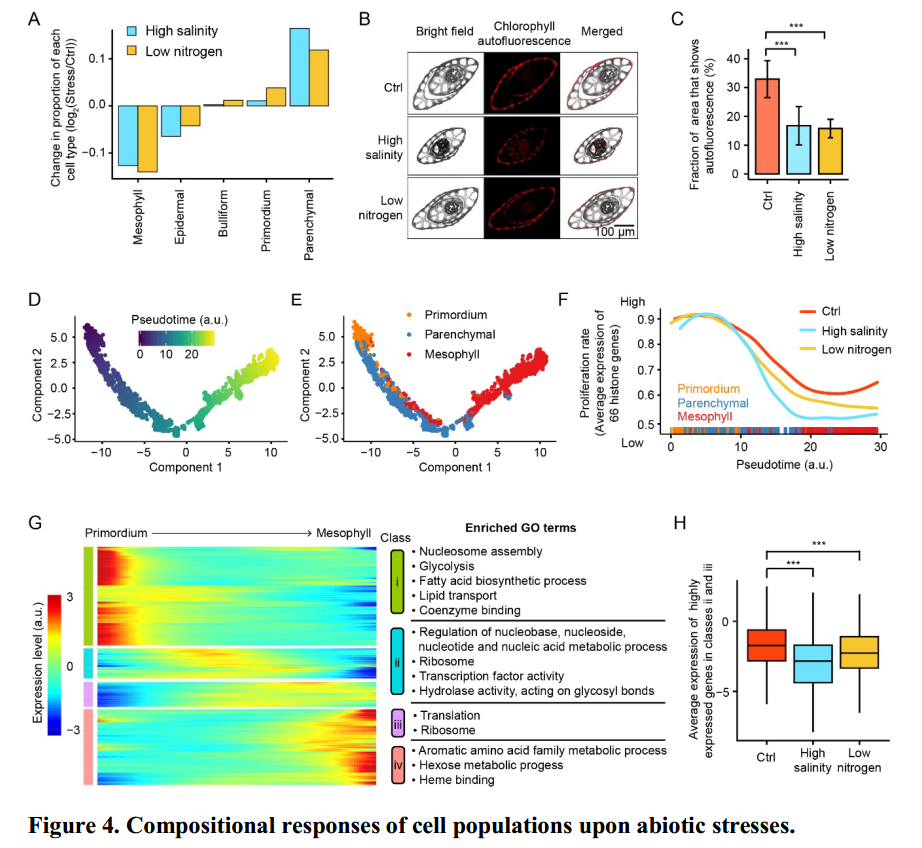
非生物胁迫延迟了原基细胞向叶肉细胞的分化
由图(Fig 4A)可知,在非生物胁迫条件下,不同类型的细胞类群大小同样存在变化。特别是叶肉细胞和薄壁细胞,一个降低而另一个升高。在显微镜下观察发现,与正常处理相比,非生物胁迫条件下叶肉细胞的红色自发荧光的强度降低了50%左右,进一步印证了非生物胁迫条件下叶肉细胞分化的延迟(Fig 4B-C)。
接下来,作者重新构建了叶肉细胞、薄壁细胞与原基细胞的发育轨迹(Fig 4D-E)。由图可知,原基细胞作为起点,叶肉细胞作为终点,而薄壁细胞作为中间态细胞。
为了进一步研究非生物胁迫对细胞分化发育的影响,作者使用66个组蛋白编码基因的平均表达水平来推断细胞的增值率。在图Fig 4F中可以看到,随着发育时间的增大,三种条件下细胞的分裂速率也急剧下降,特别是在薄壁细胞向叶肉细胞分化的过程中。因此,该结果解释了图Fig 4A中所观察到的现象。
为了解释在非生物胁迫条件下抑制薄壁细胞向叶肉细胞分化的分子机制,作者对分化轨迹上1496个高变异基因进行聚类分析(Fig 4G-H)。图Fig 4G中ClassII与ClassIII中的基因位于分化轨迹的中间过程,因此与薄壁细胞向叶肉细胞分化的过程相关。通过GO富集分析,作者发现这些基因大部分与核苷酸代谢和翻译相关,而且与正常条件相比,这些基因的表达水平被抑制,这一结果与叶肉细胞的延迟发育相呼应。
由于薄壁组织细胞在脂质储存和代谢中发挥作用,这通常与应激反应有关(Dionisio Sese和Tobita,1998;Huang,2018)。叶肉细胞发育的延迟不仅有利于水稻幼苗,减少了光合作用所消耗的能量,而且提高了对恶劣环境的抵抗力。
单细胞文章解析(4):Single-cell transcriptome analyses recapitulate the cellular and developmental responses to abiotic stresses in rice